- Autor Jason Gerald [email protected].
- Public 2023-12-16 11:01.
- Naposledy změněno 2025-06-01 06:05.
Pokud vám periodická tabulka připadá matoucí a těžko pochopitelná, nebojte se, nejste sami! Pochopení fungování periodické tabulky může být obtížné, ale když se ji naučíte číst, budete ve vědě úspěšní. Začněte porozuměním struktuře v periodické tabulce a informacím, které zobrazuje o prvcích. Dále můžete studovat každý z prvků. Nakonec pomocí informací uvedených v periodické tabulce zjistěte počet neutronů v atomu.
Krok
Část 1 ze 3: Porozumění struktuře periodické tabulky
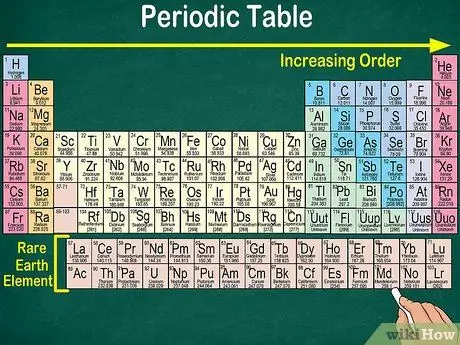
Krok 1. Přečtěte si periodickou tabulku zleva nahoře vpravo dole
Prvky jsou uspořádány podle jejich atomového čísla. Čím dále doprava a dolů, tím vyšší je atomové číslo. Atomové číslo je počet protonů, které má atom prvku. Když půjdete dále doprava, všimnete si také, že se zvyšuje hmotnostní číslo každého atomu. To znamená, že můžete pochopit váhu prvku i pouhým pohledem na jeho umístění na stole.
- Čím více doprava nebo dolů se atomová hmotnost prvku zvýší, protože atomová hmotnost se vypočítá sečtením protonů a neutronů v každém atomu prvku. S prvkem roste počet protonů, což znamená, že se zvyšuje i jeho hmotnost.
- Elektrony nejsou zahrnuty v atomové hmotnosti, protože ve srovnání s protony a neutrony nemají elektrony na atomovou hmotnost velký vliv.

Krok 2. Pochopte, že každý prvek obsahuje o 1 proton více než atom nalevo
Poznáte to podle atomového čísla. Atomová čísla jsou uspořádána zleva doprava. Prvky jsou také rozděleny do 3 skupin, seskupení vidíte v tabulce.
Například první řádek uvádí vodík, který má atomové číslo 1, a helium, které má atomové číslo 2. Tyto dva prvky jsou však umístěny zcela vlevo a vpravo od tabulky, protože jsou v různých skupinách
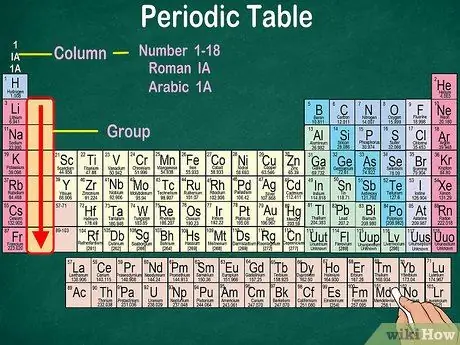
Krok 3. Identifikujte skupiny atomů, které mají stejné fyzikální a chemické vlastnosti
Skupiny jsou označeny svislými sloupci. Skupiny se ve většině případů vyznačují stejnou barvou. To vám pomůže určit, které prvky mají podobné fyzikální a chemické vlastnosti. Díky tomu budete snáze předvídat reakce těchto prvků. Každý prvek v dané skupině má ve svém nejvzdálenějším orbitálu stejný počet elektronů.
- Většina prvků patří pouze do jedné skupiny. Vodík však může být klasifikován buď jako halogen nebo jako alkalický kov. V některých tabulkách se vodík objevuje v obou skupinách.
- Ve většině případů budou sloupce očíslovány 1-18, buď v horní nebo dolní části tabulky. Čísla lze zobrazit římskými číslicemi (IA), arabskými číslicemi (1A) nebo číslicemi (1).
- Přečtěte si atomové skupiny shora dolů.
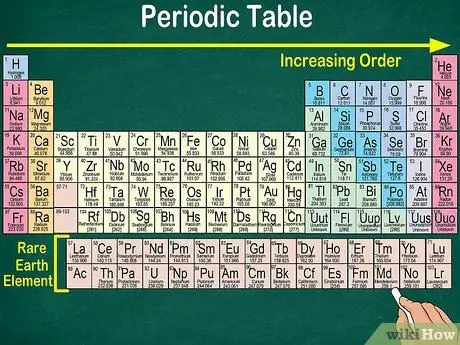
Krok 4. Všimněte si prázdného místa v tabulce
Uspořádání prvků do skupin a skupin zohledňuje kromě atomového čísla také stejné fyzikální a chemické vlastnosti. Tímto způsobem lépe porozumíte tomu, jak každý prvek reaguje. Přidání chemických prvků ztěžuje jejich klasifikaci, takže není divu, že periodická tabulka obsahuje prázdné místo.
- Například první 3 řádky mají prázdná místa, protože přechodové kovy, které se objevují v tabulce, jsou prvky s atomovým číslem 21.
- Podobně prvky 57 až 71, které jsou prvky vzácných zemin nebo prvky vzácných zemin, jsou zobrazeny samostatně v pravé dolní části tabulky.
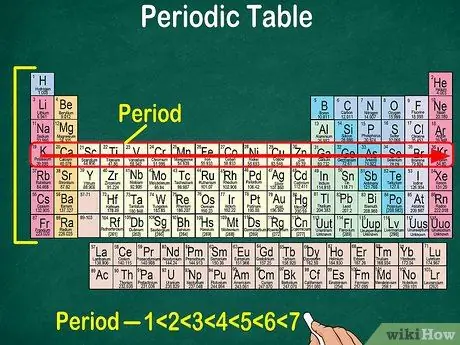
Krok 5. Všimněte si, že každý řádek se nazývá tečka
Všechny prvky v období mají stejný počet atomových orbitálů, kterými procházejí elektrony. Počet orbitálů bude odpovídat počtu teček. Periodická tabulka zobrazuje 7 řádků, což znamená, že existuje 7 period.
- Například prvek v období 1 má 1 orbitál, zatímco prvek v období 7 má 7 orbitálů.
- Ve většině případů jsou tečky očíslovány 1-7 shora dolů na levé straně tabulky.
- Odečtěte periodu prvků za řádkem zleva doprava.
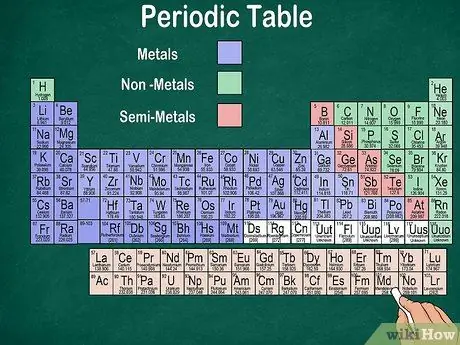
Krok 6. Rozlišujte mezi kovy, polokovy a nekovy
Vlastnosti prvků můžete lépe porozumět rozpoznáním typu prvku. Naštěstí většina periodické tabulky používá barvu k označení, zda je prvek kovový, polokovový nebo nekovový. Na pravé straně stolu najdete kovové prvky, na levé straně nekovové. Skupina polokovů se nachází mezi kovy a nekovy.
- Pamatujte, že vodík může být kvůli svým vlastnostem seskupen s halogeny nebo alkalickými kovy. Proto je přirozené, že se vodík objevuje na obou stranách stolu nebo má jinou barvu.
- Prvek se nazývá kov, pokud je lesklý, pevný při pokojové teplotě, vede teplo a elektřinu a je měkký a pružný.
- Prvek je považován za nekovový, pokud není lesklý, nevede teplo ani elektřinu a je tvrdý. Tyto prvky jsou obvykle při pokojové teplotě plynné, ale při určitých teplotách mohou být také pevné nebo kapalné.
- Prvek se nazývá polokov, pokud má kombinované vlastnosti kovu a nekovu.
Část 2 ze 3: Studium prvků
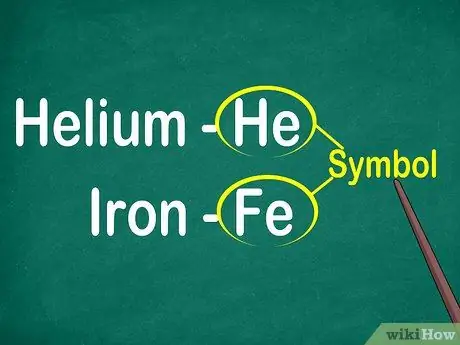
Krok 1. Identifikujte symboly prvků od 1 do 2 písmen
Symbol se obvykle nachází uprostřed čtverce s velkým písmem. Symboly jsou zkratky pro názvy prvků, které byly standardizovány v různých jazycích. Při experimentech nebo práci na elementárních rovnicích pravděpodobně použijete symboly prvků. Ať se vám to líbí nebo ne, musíte se seznámit s elementárními symboly.
Symboly jsou obvykle odvozeny z latinského názvu prvku, ale někdy jsou odvozeny od názvů, které jsou široce používány, zejména nové prvky. Například symbolem pro Helium je On, což znamená toto známé jméno. Symbolem železa je však Fe, což je na první pohled poměrně obtížně rozpoznatelné

Krok 2. Najděte úplný název prvku, pokud existuje
Toto je název prvku, který použijete, pokud jej budete muset zapsat celý. Například „Helium“a „Carbon“jsou názvy prvků. Ve většině případů je název prvku pod symbolem, ale umístění se může lišit.
Některé periodické tabulky nemusí obsahovat úplný název a používat pouze symboly
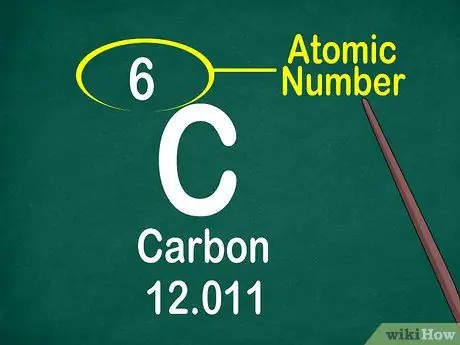
Krok 3. Poznamenejte si atomové číslo
Atomové číslo je obvykle umístěno v horní části rámečku, buď uprostřed, nebo v rohu rámečku. Atomové číslo však může být také umístěno pod symbolem prvku nebo názvem prvku. Atomová čísla jsou řazena od 1-118.
Atomové číslo je celé číslo, nikoli desetinné číslo
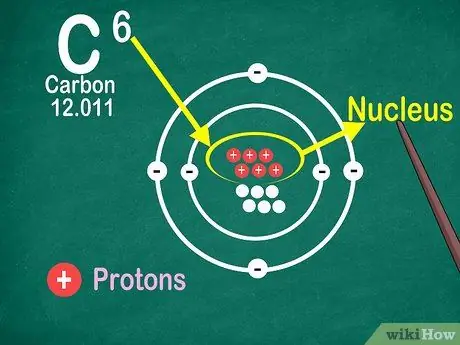
Krok 4. Vězte, že atomové číslo je počet protonů v atomu
Všechny atomy v prvku mají stejný počet protonů. Na rozdíl od elektronů nemohou být protony zachyceny nebo uvolněny atomy. Prvky se změní, pokud atomy mohou atomy zachytit nebo ztratit.
Atomové číslo potřebujete také ke zjištění počtu elektronů a neutronů
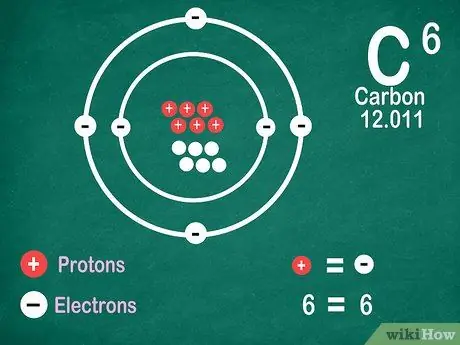
Krok 5. Vězte, že prvky obsahují stejný počet elektronů jako protony, pokud prvek neprochází ionizací
Protony mají kladný náboj, zatímco elektrony záporný. Protože neutrální atom nemá elektrický náboj, znamená to, že má stejný počet elektronů a protonů. Atomy však mohou ztratit a získat elektrony, což je ionizuje.
- Ionty jsou elektrické náboje. Pokud je v iontu více protonů, náboj je kladný, což je kladné (+) znaménko vedle symbolu iontu. Pokud je počet elektronů v iontu větší, je náboj záporný, což je záporný (-).
- Pokud atom není ion, neuvidíte kladné ani záporné znaménko.
Část 3 ze 3: Použití atomové hmotnosti k počítání neutronů

Krok 1. Znát atomovou hmotnost
Atomová hmotnost se obvykle nachází ve spodní části rámečku pod symbolem prvku. Atomová hmotnost je kombinovaná hmotnost částic v atomovém jádru, včetně protonů a neutronů. Ionty však mohou zkomplikovat proces počítání. Atomová hmotnost tedy udává průměrnou atomovou hmotnost prvku a atomovou hmotnost jeho iontů.
- Kvůli své průměrné hmotnosti má většina atomů atomové hmotnosti v desítkové formě.
- Přestože váha prvku vypadá, jako by se zvyšovala zleva doprava, není tomu tak vždy.
Krok 2. Určete hmotnostní číslo prvku, který studujete
Hmotnostní číslo najdete zaokrouhlením atomové hmotnosti. Tato skutečnost dokazuje, že atomová hmotnost je průměrem všech atomových hmot, včetně iontů.
Atomová hmotnost uhlíku je například 12 011, takže je zaokrouhlena na 12. Podobně je atomová hmotnost železa 55,847, takže je zaokrouhlena nahoru na 56
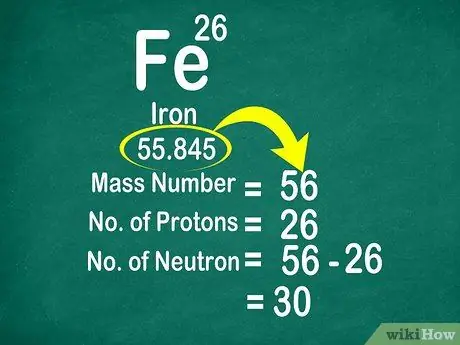
Krok 3. Odečtěte hmotnostní číslo od atomového čísla a spočítejte neutrony
Hmotnostní číslo lze vypočítat přičtením počtu protonů k počtu neutronů. To vám usnadní výpočet počtu neutronů v atomu odečtením hmotnostního čísla od počtu protonů
- Použijte tento vzorec: Neutron = hmotnostní číslo - proton
- Například hmotnostní číslo uhlíku je 12 a má 6 protonů. Můžeme tedy vědět, že uhlík má 6 neutronů, protože 12 - 6 = 6.
- Další příklad, hmotnostní počet železa je 56 a má 26 protonů. Víme tedy, že železo má 30 neutronů, protože 56 - 26 = 30.
- Izotopy atomů obsahují různý počet neutronů, takže se mění jejich atomové hmotnosti.
Tipy
- Číst periodickou tabulku je pro některé lidi obtížné. Nenechte se odradit, pokud je pro vás studium periodické tabulky obtížné!
- Barvy v tabulce se mohou lišit, ale obsah zůstává stejný.
- Některé periodické tabulky mohou poskytovat neúplné informace. Některé tabulky například uvádějí pouze symbol a atomové číslo. Za tímto účelem vyhledejte stůl, který vyhovuje vašim potřebám!






