- Autor Jason Gerald [email protected].
- Public 2023-12-16 11:01.
- Naposledy změněno 2025-01-23 12:14.
Ředění je proces, ve kterém je koncentrovaný roztok zředěnější. Existuje řada důvodů, proč by někdo mohl chtít provést ředění, od vážných po jednoduché důvody. Biochemici například ředí roztoky ze svých koncentrovaných forem, aby vytvořili nová řešení pro použití v experimentech, zatímco na druhé straně barmani často ředí likér nealkoholickými nápoji nebo džusy, aby byly koktejly chutnější. Obecný vzorec pro výpočet ředění je C1PROTI1 = C.2PROTI2, s C.1 a C.2 představuje počáteční a konečnou koncentraci roztoku, respektive V1 a V.2 představuje objem.
Krok
Metoda 1 ze 2: Přesně ředící koncentráty pomocí rovnice ředění

Krok 1. Zjistěte, co víte a nevíte
Ředění v chemii obvykle znamená odebrat malé množství roztoku, jehož koncentraci znáte, a poté přidat neutrální kapalinu (například vodu), čímž vytvoříte nový roztok s větším objemem, ale nižší koncentrací. To se velmi často provádí v chemických laboratořích, protože z důvodu účinnosti se činidla často skladují ve velmi vysokých koncentracích, které se poté ředí pro použití v experimentech. Obvykle ve většině situací v reálném světě budete znát koncentraci vašeho počátečního roztoku a koncentraci nebo objem, který chcete, aby vaše konečná koncentrace byla, ale ne objem počátečního roztoku, který potřebujete k získání konečného řešení.
- V jiných situacích (zejména ve školních problémech) však možná budete muset najít další dílky skládačky - například vám může být poskytnut počáteční objem a koncentrace a poté požádán o nalezení konečné koncentrace, pokud zředíte roztok. na požadovanou hlasitost. V každém případě ředění je užitečné si před zahájením všimnout známých i neznámých proměnných.
-
Dokončeme příklady otázek. Předpokládejme, že jsme požádáni o zředění 5 M roztoku vodou tak, aby byl vyroben 1 L 1. roztoku mM. V tomto případě známe koncentraci našeho počátečního roztoku a požadovaný objem a konečnou koncentraci, ale ne množství počátečního roztoku, které potřebujeme přidat s vodou, abychom dosáhli požadovaného výsledku.
Připomínka: V chemii je M měření koncentrace zvané Molarity, které označuje moly látky na litr
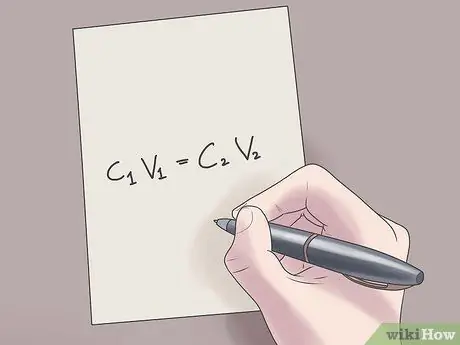
Krok 2. Připojte své hodnoty do vzorce C1PROTI1 = C.2PROTI2.
V tomto vzorci C1 je počáteční koncentrace roztoku, V1 je objem počátečního roztoku, C2 je konečná koncentrace roztoku a V2 je objem konečného roztoku. Zapojení známých hodnot do této rovnice vám pomůže najít neznámé hodnoty s menšími obtížemi.
- Může být užitečné umístit před jednotku, kterou chcete hledat, otazník, aby vám to pomohlo vyřešit.
-
Pokračujme v našem příkladu. Hodnoty, které známe, zadáme následovně:
- C1PROTI1 = C.2PROTI2
- (5 M) V1 = (1 mM) (1 L). Naše dvě koncentrace mají různé jednotky. Zastavme se zde a přejděte k dalšímu kroku.

Krok 3. Zvažte případné jednotkové rozdíly
Protože řešení zahrnují změny koncentrace (které mohou být někdy docela velké), není neobvyklé, že dvě proměnné ve vaší rovnici mají různé jednotky. I když je to snadno přehlédnutelné, nerovné jednotky ve vaší rovnici mohou způsobit, že vaše odpověď bude nesprávná. Před dokončením převeďte všechny hodnoty s různými jednotkami koncentrace a/nebo objemu.
-
V našem příkladu používáme různé jednotky pro koncentrace M (moláry) a mM (milimoláry). Změňme naše druhé měření na M:
- 1 mM × 1 M/1 000 mM
- = 0,001 mil

Krok 4. Dokončete
Jakmile jsou všechny jednotky stejné, vyřešte svou rovnici. To lze téměř vždy provést pomocí jednoduché algebry.
-
Zde zastavíme náš příkladový problém: (5 M) V1 = (1 mM) (1 L). Pojďme najít hodnotu V1 s naší novou jednotkou.
- (5 M) V1 = (0,001 M) (1 L)
- PROTI1 = (0,001 M) (1 L)/(5 M).
-
PROTI1 = 0,0002 l nebo 0,2 ml.

Krok 5. Pochopte, jak správně používat svou odpověď
Řekněme, že jste našli chybějící hodnotu, ale nejste si jisti, jak tyto nové informace použít ve skutečném ředění, které musíte udělat. To je pochopitelné - jazyk matematiky a přírodních věd někdy neodpovídá skutečnému světu. Když znáte čtyři hodnoty v rovnici C1PROTI1 = C.2PROTI2, proveďte ředění následujícím způsobem:
- Změřte objem V1 z roztoku o koncentraci C1. Poté přidejte dostatečné množství ředidla (voda atd.), Aby byl celkový objem V2. Toto nové řešení bude mít požadovanou koncentraci (C.2).
- V našem příkladu například nejprve změříme 0,2 ml 5M roztoku. Dále přidáme tolik vody, aby se objem roztoku zvýšil na 1 L: 1 L - 0,0002 L = 0,9998 L nebo 999, 8 ml. Jinými slovy, do našeho malého roztoku vzorku přidáme 999,8 ml vody. Náš nový zředěný roztok má koncentraci 1 mM, což je naše požadovaná koncentrace.
Metoda 2 ze 2: Vytvoření jednoduchého a praktického ředicího roztoku

Krok 1. Přečtěte si informace na obalu
Existuje celá řada důvodů, proč byste si mohli chtít připravit ředicí roztok doma, v kuchyni nebo v jiné nechemické laboratoři. Například výroba pomerančové šťávy z jednoduchého koncentrátu je ředění. V mnoha případech výrobek, který je třeba ředit, obsahuje informace o ředění, které je třeba provést, někde na obalu. Mohou mít přesné pokyny, které je třeba dodržovat. Zde je několik věcí, které je třeba hledat při hledání informací:
- Použitý objem produktu
- Objem použitého ředidla
- Typ použitého ředidla (obvykle voda)
- Speciální pokyny pro míchání
- Je možné, že neuvidíte informace o přesné koncentraci použité kapaliny. Tyto informace nejsou pro průměrného spotřebitele užitečné.

Krok 2. Do koncentrovaného roztoku přidejte látku, která působí jako ředidlo
U jednoduchých ředění pro domácnost, jako jsou ta, která můžete vyrobit v kuchyni, potřebujete znát pouze objem koncentrátu, který používáte, a přibližnou konečnou koncentraci, kterou chcete, než začnete. Koncentrát zřeďte příslušným množstvím ředidla, které se stanoví v závislosti na objemu použitého počátečního koncentrátu. Viz. níže:
- Pokud bychom například chtěli zředit 1 šálek koncentrátu pomerančové šťávy na 1/4 původní koncentrace, přidali bychom 3 šálky vody do koncentrátu. Naše finální směs bude mít 1 šálek koncentrátu ve 4 šálcích celé tekutiny - 1/4 původní koncentrace.
- Zde je složitější příklad: Pokud bychom chtěli ředit 2/3 šálku koncentrátu na 1/4 jeho počáteční koncentrace, přidali bychom 2 šálky vody, protože 2/3 šálku se rovná 1/4 krát 2 a 2/3 šálku celá tekutina.
- Přidejte látku do dostatečně velké nádoby, aby pojala požadovaný objem - velkou misku nebo podobnou nádobu.

Krok 3. Objem prášku ve většině případů ignorujte
Přidání prášku (například určitých nápojových směsí) do kapaliny se obvykle nepovažuje za ředění. Změna objemu vyplývající z přidání malého množství prášku do kapaliny je obvykle dostatečně malá, aby byla zanedbatelná. Jinými slovy, když přidáváte malé množství prášku do kapaliny, přidejte prášek do požadovaného konečného objemu kapaliny a promíchejte.
Varování
- Dodržujte všechny bezpečnostní pokyny poskytnuté výrobcem nebo požadované vaší společností. To je zvláště důležité, pokud musíte zředit kyselý roztok.
- Práce s kyselými roztoky může vyžadovat podrobnější bezpečnostní opatření a pokyny než s nekyselými roztoky.






